[Challenges in the management of Monkeypox in a developing country: case of Cameroon]
Les défis de la prise en charge de la variole du singe dans un pays en voie de développement: cas du Cameroun
Odette Berline Sigha 1,2, Sike Christiane Medi3, Grâce Anita Nkoro3,4, Marie Solange Ndom5,6, Marthe-Liliane Mbenoun7, Joséphine Kamdem7, Noël Emmanuel Essomba5, Emmanuel Armand Kouotou3
1,2, Sike Christiane Medi3, Grâce Anita Nkoro3,4, Marie Solange Ndom5,6, Marthe-Liliane Mbenoun7, Joséphine Kamdem7, Noël Emmanuel Essomba5, Emmanuel Armand Kouotou3
1Faculty of Health Sciences, University of Bamenda, Bambili, Cameroon, 2Service de Dermatologie, Hôpital Laquintinie de Douala, Cameroun, 3Faculté de Médecine et des Sciences Biomédicales, Université de Yaoundé 1, Cameroun, 4Service de dermatologie, Hôpital Gynéco-obstétrique et Pédiatrique de Yaoundé, Cameroun, 5Faculté de Médecine et des Sciences Pharmaceutiques, Université de Douala, Cameroun, 6Service de cardiologie, Hôpital Laquintinie de Douala, Cameroun, 7Service d’infectiologie Hôpital Laquintinie de Douala, Cameroun
Citation tools:
Copyright information
© Our Dermatology Online 2024. No commercial re-use. See rights and permissions. Published by Our Dermatology Online.
ABSTRACT
International interest has been focused on Monkeypox since July 2022, due to multiples cases reported outside Africa. We report a case that occurred in Cameroon during this period. A 40-year-old Patient, heterosexual, living in Tombel in the southwest of Cameroon, HIV positive, consulted on 02/10/2022 for umbilicated, confluent vesiculo-pustular lesions, confluent on the face and scalp with palmo-plantar involvement, without lymphadenopathy, febrile, and evolving for 2 weeks. The diagnosis of Monkeypox was made based on a positive PCR test from on a skin sample revealing the Monkeypox clade 2 virus. Under treatment, the evolution was favourable after 17 days. We report the first confirmed case of Monkeypox in the city of Douala. The major challenge for the government would be to develop diagnostic and response strategies, to contain and neutralize the disease.
Key words: Monkeypox, Cameroon, pandemic
RÉSUMÉ
L’intérêt international est porté sur la variole du singe depuis juillet 2022 devant la multiplicité des cas hors de l’Afrique. Nous rapportons un cas survenu au Cameroun durant cette période. Un patient de 40 ans, hétérosexuel, Vivant à Tombel au Sud-ouest du Cameroun, VIH positif, consultait le 02/10/2022 pour des lésions vésiculo-pustuleuses ombiliquées, confluentes au visage et au cuir chevelu avec atteinte palmo-plantaire, sans adénopathie, fébrile, et évoluant depuis 2 semaines. Le diagnostic de variole du singe a été retenu devant la positivité de la PCR réalisée sur prélèvement cutané mettant en évidence le Monkeypox virus de clade 2. Sous traitement, l’évolution a été favorable au bout de 17 jours. Nous rapportons le premier cas confirmé de Monkeypox dans la ville de Douala. L’enjeu majeur pour le gouvernement est de développer des stratégies diagnostic et de riposte, afin de contenir et neutraliser la maladie.
Mots clés: Monkeypox, Cameroun, pandémie
INTRODUCTION
La variole du singe ou Monkeypox est une zoonose virale endémique s’sévissant principalement jusqu’à lors en Afrique (régions rurales et zones de forêts tropicales humides du bassin du Congo). Le premier cas humain a été signalé en 1970 chez un enfant de 9 mois admis à l’hôpital Basankusu en République démocratique du Congo [1,2]. Elle se transmet à travers des réservoirs animaux (rongeurs, singes, écureuils arboricoles et chiens de prairie), mais aussi à travers la consommation de viande de brousse et d’homme à homme par contact direct étroit [3,4].
En 2003, l’intérêt international est porté sur cette maladie lorsque qu’une épidémie est déclarée aux États-Unis avec 82 cas humains; la source de l’infection étant des rongeurs sauvages expédiés du Ghana porteurs du Monkeypox virus ayant contaminé des chiens de prairie, lesquels ont à leur tour infesté des humains amateurs d’animaux de compagnie [1,2,5].
Depuis fin avril 2022, une épidémie de Monkeypox est en cours dans 105 pays d’Amérique et d’Europe. Le 23 juillet 2022 une alerte mondiale est lancée par l’OMS qui en date du 24 septembre 2022 déclarait 64728 cas confirmés biologiquement (62 % en Amérique et 38 % en Europe et seulement 0.1% de cas en Afrique) suscitant un intérêt international pour cette zoonose autrefois négligée [1,5].
Les caractéristiques épidémiologiques et cliniques de cette épidémie sont différentes de celles établies pour le Monkeypox depuis son isolement initial et son identification et pendant les épidémies précédentes notamment en Afrique; la transmission sexuelle étant suspectée principalement avec la communauté des homosexuels masculins touchée de façon disproportionnée (95%) [2,5]. Au Cameroun, depuis le lancement de l’alerte mondiale en juillet jusqu’en septembre 2022, 09 cas de variole du singe ont été confirmés ces cas se situent plus dans les régions forestières ou importés dans régions forestières pour se retrouver en ville comme c’est le cas de notre patient [6].
Nous rapportons un des cas confirmés de variole du singe durant cette période de pandémie, décelé dans la région du littoral à Douala (capitale économique du Cameroun) provenant de la région du sud-ouest (zone forestière).
OBSERVATION
Il s’agissait d’un patient de 40 ans, Conducteur de camion, hétérosexuel, Vivant à Tombel (région du Sud-ouest) immunodéprimé au VIH depuis 5 ans pour lequel il était suivi et sous traitement (Dolutégravir 50 mg – Lamivudine 300 mg – Ténofovir 300 mg); Il consultait le 02/10/2022 aux urgences de l’hôpital Laquintinie Douala pour une éruption cutanée généralisée fébrile sans céphalées évoluant depuis 2 semaines. L’histoire de la maladie révélait que tout aurait débuté 4 semaines avant par un tuméfaction inflammatoire fistulisée de la cuisse droite pour laquelle le patient bénéficiait de pansements régulièrement faits à l’hôpital de district de sa ville; 2 semaines après apparaissait en contexte fébrile une éruption cutanée prurigineuse du visage se propageant rapidement, pour laquelle il aurait été hospitalisé et mis sous un traitement de nature inconnu, devant l’aggravation de la symptomatologie, le patient est référé à l’hôpital Laquintinie de Douala pour une meilleure prise en Charge.
A l’examen général, le patient était conscient avec un état général conservé, une température à 38°,4C et sans adénopathies. L’examen dermatologique notait une éruption cutanée généralisée (photo 1), faite de lésions vésiculo-pustuleuses ombiliquées, ulcérées par endroit, confluentes au visage (photo 2) et au cuir chevelu avec atteinte palmo-plantaire. Par ailleurs au niveau de la face latéro-interne de la cuisse gauche, on notait une vaste ulcération à fond sale. L’examen neurologique de même que le digestif étaient normaux. Notons que le reste l’examen physique était sans particularité.
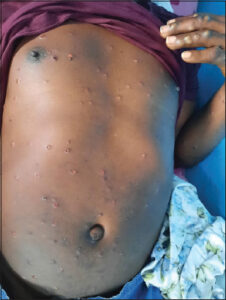 |
Photo 1: Lésions vésiculo-pustuleuses ombiliquées et ulcérées du tronc. |
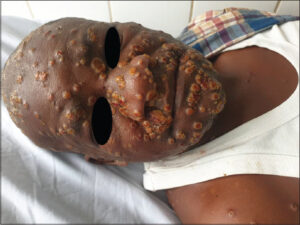 |
Photo 2: Lésions vésiculo-pustuleuses ombiliquées et ulcérées du visage. |
Devant ce tableau clinique plusieurs hypothèses diagnostiques ont été émises notamment celle d’une cryptococcose cutanée, et celle d’une dermatose virale (variole du singe vs varicelle maligne). Les examens paracliniques réalisés révélaient:
- Une hyperleucocytose à 12.900/mm3;
- Une C Reactiv Protein (CRP) positive (96mg/l);
- Une glycémie normale à 0,86g/l;
- Des sérologies hépatiques négatives (Ag HBS et AC anti HCV);
- Charge virale du VIH à 71 copies/mL;
- Un prélèvement mycologique négatif au cryptococcoque;
- Une PCR sur prélèvement cutané positive au Monkeypox virus de clade 2 positif.
Nous avons donc retenu le diagnostic de variole du singe et une alerte a été lancée par l’hôpital et vers les services de surveillance des épidémies du ministère de la santé du Cameroun.
Notre patient a été mis en isolement sous le traitement suivant:
- Aciclovir 400mg, 5 fois par jour per os
- Bi-antibiothérapie (Ceftriaxone et Amikacine)
- soins locaux faits de: bain avec une solution Chlorhexidine et application d’acide Fusidique en crème sur les lésions; pansement quotidien de l’ulcération de la cuisse gauche avec de la Trolamine en crème.
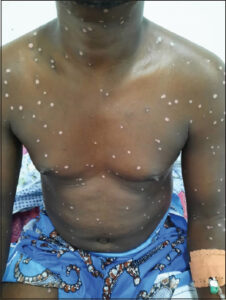
L’évolution a été marquée après 17 jours de traitement par un assèchement complet de lésions (photo 3). Au 21ème jour, on retrouvait uniquement des macules hyperpigmentées post- lésionnelles.
DISCUSSION
Il existe 2 clades génétiques distincts du Monkeypox virus, le clade centrafricain ou clade1 associée à une transmissibilité et une létalité plus élevée (11 à 15%) et le clade ouest-africain ou clade 2 entrainant généralement une maladie spontanément résolutive avec un taux de létalité de 3 à 6%. Le risque est plus élevé chez les enfants et les jeunes adultes et la maladie peut évoluer sévèrement chez les patients immunodéprimés [7]. Le clade ouest Africain ou clade 2 est celui impliqué dans l’épidémie actuelle [8]. Sur le plan clinique, le Monkeypox a une période d’incubation allant de cinq jours à trois semaines, les symptômes pouvant durer près de 2 à 5 semaines. Les prodromes sont: fièvre, frissons, céphalées, polyarthralgies, polyadénopathies (présents chez 90% des patients) [8,9]. Au cours de cinq jours suivant la fièvre, des éruptions cutanées de différentes tailles se développent d’abord sur le visage et le cuir chevelu puis s’étendent sur le tronc et les extrémités y compris les paumes et la plante des pieds. Les lésions commencent comme par une macule, puis évolue vers des papules, puis des vésicules ombiliquées et pustules qui s’ulcèrent, puis évoluent en croutes [7–9]. Les lésions peuvent être douloureuses et un prurit peut survenir lorsque les lésions sont en phase de guérison [8]. Les patients sont contagieux du début des symptômes jusqu’au stade de croutes [10,11]. Dans l’épidémie actuelle de 2022, la présentation clinique de Monkeypox est atypique chez de nombreux patients car, l’éruption cutanée est limitée aux régions génitale, périgénitale périanale et présent à différents stades de développement; de plus les patients peuvent ne présenter que des symptômes prodromiques légers ou absents qui peuvent commencer après l’apparition des lésions cutanées [8]. Dans notre cas, notre patient positif au Monkeypox virus de clade 2, immunodéprimé au VIH et provenant d’une région forestière avait des lésions généralisées comme ce qui se rencontre habituellement dans la forme endémique du Monkeypox dû au clade 1. Le clade 2 étant généralement connu pour être paucisymtomatique, son immunodépression au VIH pourrait être la cause de l’aggravation de sa maladie.
Les techniques de confirmation utilisées pour l’analyse les échantillons et déterminer le Monkey comprennent les méthodes génétiques, phénotypique et immunologique [12]; l’examen principal pour établir le diagnostic est la PCR qui est d’une grande précision et une et une grande sensibilité [7,8], cette dernière a pu être effectué chez notre patient ce qui permis de confirmer le diagnostic. Il n’existe à ce jour aucun traitement spécifique pour le Monkeypox. En milieu hospitalier, le Center for Disease Control (CDC) recommande que les patients soient isolés dans des chambres à pression négative et que les professionnels de santé prennent des précautions adéquates contre les contacts et les gouttelettes [9,13]. Le pilier de la prise en charge clinique étant les soins d’accompagnement à savoir le maintien de l’équilibre hydrique, la prévention et le traitement des surinfections bactériennes [8]. Alors que la plupart des cas aura une maladie bénigne et spontanément résolutive, les soins d’accompagnement étant généralement suffisants, les antiviraux (Tecovirimat, Brincidofovir, Cidofovir) et les Immunoglobuline vaccinales intraveineuses sont disponible comme traitement, mais aucune étude ne prouve leur efficacité [8]. Le diagnostic ayant été suspecté précocement et confirmé chez notre patient, il a été mis en isolement et a bénéficié des soins d’accompagnement adéquats; les antiviraux recommandés n’étant pas disponible dans notre pays, notre patient a été mis sous Aciclovir, avec une évolution clinique favorable. Ceci prouvant la probable efficacité de cette molécule.
La prévention de la propagation du Monkeypox est une guerre menée sur de nombreux fronts. La principale stratégie de prévention de la variole du singe consiste:
- A sensibiliser les populations aux facteurs de risque et à les éduquer aux mesures à prendre pour réduire l’exposition au virus, cela commence par la limitation l’exposition des humains aux animaux hôtes suspects [5].
- De protéger les groupes à risques qui comprennent les travailleurs de santé les contacts des personnes contacts des patients Monkeypox. Pour cela, le CDC recommandé d’utiliser un vaccin antivariolique de 3ème génération afin de limiter les effets secondaires observés avec les vaccins antérieurs [1]. Deux vaccins sont actuellement disponibles, JYNNEOSTM® (approuvé pour la prévention de la variole du singe en 2019) aussi connu sous le nom de IMVAMUNE®, IMVANEX®, qui est un vaccin vivant produit à partir de la vaccine modifiée Ankara qui est un orthopoxvirus atténué non réplicatif et ACAM2000® fabriqué à partir d’un virus de la vaccine vivant et capable de se répliquer, disponible depuis aout 2007 [1,5,7].
La ville de Tombel est une ville forestière située au sud-ouest Cameroun; cette région fait face depuis 2015 à une crise sociologique qui a entraimé le déplacement des populations et certaines s’étant refugié dans les forêts avoisinantes pour fuir les représailles. Ceci facilitant le contant entre l’homme et le réservoir animal, le risque de cette situation est tout d’abord qu’on pourrait avoir une augmentation du nombre de cas, et qu’avec la mobilité des populations les patients puissent se retrouver dans les grandes villes avec une possibilité de contamination importantes, entrainant ainsi une généralisation de l’épidémie dans tout le pays. Les autorités sanitaires du Cameroun actuellement tentent de circonscrire l’épidémie dans ces régions: par une descente sur le terrain tout d’abord pour tracer les personnes contacts des cas confirmés afin de détecter les cas suspects (pour confirmation biologique), par des campagnes de formations du personnel médical a la reconnaissance de la maladie et d’informations des populations via les medias, mais aussi par la créations des plates-formes d’échanges entre les différents professionnels impliqués dans la prise en charge de cette maladie.
Notre pays étant en voie de développement, cette tache gouvernementale n’est pas facile car:
- Malgré le fait que plusieurs laboratoires dans le pays à ce stade de la pandémie soient habiletés à réaliser la PCR Monkeypox virus, seul le centre Pasteur de Yaoundé (situé dans la région du centre au Cameroun) est capable de rendre ce résultat dans les 24h; De ce fait, tous les prélèvements dont le nôtre y sont acheminés. Ceci pourrait avoir pour conséquences, détérioration des prélèvements (par conservation inadéquate), une surcharge de travail entrainant un retard de réponse donc retard de prise en charge adéquate. L’élaboration des tests de diagnostic rapide serait d’une grande aide dans notre contexte.
- Les zones où sévissent la pathologie sont des zones reculées forestières où les populations vivent encore de la chasse, et où sévit pour certaines la crise sociopolitique qui affecte notre pays depuis 2015 ayant poussée les personnes à fuir les zones urbaines pour se réfugier en forets. Sachant que les animaux réservoirs sont ceux qui servent de nourriture dans ces zones, l’état devrait aussi impliquer en plus les agents de santé locaux, les autorités traditionnelles afin de sensibiliser les populations,
- Les habitudes des populations de se tourner vers les tradipraticiens, ceci étant une cause de sous-estimation des cas et un moyen de propagation rapide de la maladie. Car effectivement l’épidémie est sous-estimée au Cameroun.
CONCLUSION
Ce cas de Monkeypox chez un patient immunodéprimé de 40 ans, premier cas rapporté dans la région du littoral importé de la région du Sud-ouest semble être un présage des catastrophes potentielles de santé publique qui doivent être prise en compte et prévenues dès que possible. La tâche est d’autant plus difficile lorsqu’il s’agit des pays en voie de développement comme le Cameroun où la maladie est endémique et cohabite avec les comorbidités telles que le VIH, les moyens de transport d’échantillons et de diagnostic sont limités; d’autant plus que le pays ne dispose pas d’infrastructure sanitaire adéquate, pouvant gérer une catastrophe à grande échelle. L’accent devrait donc être mis dans notre contexte sur la sensibilisation des populations aux facteurs de risque et à leur éducation aux mesures à prendre pour réduire l’exposition au virus.
Consent
The examination of the patient was conducted according to the principles of the Declaration of Helsinki.
The authors certify that they have obtained all appropriate patient consent forms, in which the patients gave their consent for images and other clinical information to be included in the journal. The patients understand that their names and initials will not be published and due effort will be made to conceal their identity, but that anonymity cannot be guaranteed.
RÉFÉRENCES
1. Médecine tropicale, Variole du singe (monkeypox) [en ligne]. 2022 [citéle 10 octobre 2022]. Disponible sur:http://medecinetropicale.free.fr/cours/poxvirus.pdf
2. Bragazzi NL, Woldegerima WA, Iyaniwura SA, Han Q, Wang X, Shausan A, et al. Knowing the unknown:The underestimation of monkeypox cases. Insights and implications from an integrative review of the literature. Front Microbiol. 202223;13:1011049.
3. Awan MAE, Waseem M, Sahito AF, Sahito AM, Khatri G, Butt MA, et al. Monkeypox has devastated the world;should we prepare for the outbreak of a new pandemic?Ann Med Surg (Lond). 2022;79:104051.
4. Jarman EL, Alain M, Conroy N, Omam LA. A case report of monkeypox as a result of conflict in the context of a measles campaign. Public Health Pract (Oxf). 2022;4:100312.
5. Organisation Mondiale de la Santé, Flambée de variole du singe 2022, [en ligne]. 2022[citéle 22 septembre 2023]. Disponible sur:https://www.who.int/fr/emergencies/situations/monkeypox-oubreak-2022
6. Ministère de la santépublique du Cameroun, rapport de situation de la variole du singe au Cameroun n°3, [en ligne]. 2022 [citéle 31 juillet 2023]. Disponible sur:https://www.ccousp.cm/download/rapport-de-situation-de-la-variole-du-singe-au-cameroun-n1
7. Hraib M, Jouni S, Albitar MM, Alaidi S, Alshehabi Z. The outbreak of monkeypox 2022:An overview. Ann Med Surg (Lond). 2022;79:104069.
8. Wattal C, Datta S. Monkey Pox arrives in India. Indian J Med Microbiol. 2022;40:473-4.
9. Titanji BK, Tegomoh B, Nematollahi S, Konomos M, Kulkarni PA. Monkeypox:A contemporary review for healthcare professionals. Open Forum Infect Dis. 2022;9:ofac310.
10. Di Giulio DB, Eckburg PB. Human monkeypox:an emerging zoonosis. Lancet Infect Dis 2004;4:15–25.
11. Halani S, Mishra S, Bogoch II. The monkeypox virus. CMAJ. 2022;194:E844.
12. Fenner F, Henderson DA, Arita I, Jezek Z, Ladnyi ID. Smallpox and its eradication. Geneva:World Health Organization, 1988.
13. Shchelkunov SN, Marennikova SS, Moyer RW. Orthopoxiruses Pathogenic to Humans. New York, NY:Springer, 2005.
Notes
Request permissions
If you wish to reuse any or all of this article please use the e-mail (contact@odermatol.com) to contact with publisher.
| Related Articles | Search Authors in |
|
 http://orcid.org/0000-0003-3879-2659 http://orcid.org/0000-0003-3879-2659 |




Comments are closed.