Our Dermatol Online. 2013; 4(3): 361-368
DOI:. 10.7241/ourd.20133.91
Date of submission: 16.05.2013 / acceptance: 17.06.2013
Conflicts of interest: None
HISTOPLASMOSE AFRICAINE DISSEMINEE CHEZ UN ENFANT IMMUNOCOMPETENT AU BURKINA FASO: UN CAS DISSEMINATED AFRICAN HISTOPLASMOSIS IN AN IMMUNOCOMPETENT CHILD IN BURKINA FASO: ONE CASE
Fatou Barro/Traoré1, Myriam Sanwidi2, Fousséni Dao2, Nina Korsaga/Somé1,
Pascal Niamba1, Adama Traoré1, Ludovic Kam2, Gilles Lemasson3
1Department of Dermatology-Venerology, Yalgado Ouédraogo Teaching Hospital Center (CHU-YO), Ouagadougou, Burkina Faso
2Department of Pediatry, Yalgado Ouédraogo Teaching Hospital Center, Ouagadougou, Burkina Faso
3Clinic of pathological anatomy and cytology of Brest, France
Corresponding author: Prof. Ag. Barro/Traoré Fatou e-mail: fatou_barro@yahoo.fr
How to cite an article: Barro/Traoré F, Sanwidi M, Dao F, Korsaga/Somé N, Niamba P, Traoré A, Kam L, Lemasson G. [Disseminated African Histoplasmosis in an immunocompetent child in Burkina Faso: one case]. Our Dermatol Online. 2013; 4(3): 361-368.
Résumé
Introduction: L’histoplasmose à Histoplasma capsulatum var. duboisii est une affection rare en Afrique. Les lésions cutanées localisées sont les plus fréquentes. Nous rapportons une forme disséminée chez un enfant immunocompétent.
Observation: Une élève de 8 ans est hospitalisée pour des nodules cutanés, généralisés, associés à des douleurs ostéo-articulaires très intenses de la quasi-totalité des articulations. L’examen a noté une malnutrition aiguë modérée, des nodules sous cutanés, multiples, des papules rosées, à surface plane, des papules ombiliquées, des tuméfactions nodulaires très douloureuses de plusieurs articulations, de multiples adénopathies fermes, mobiles, une atteinte osseuse multiple à la radiographie, une hépatosplénomégalie et des ulcérations secondaires douloureuses. L’histologie d’un nodule cutané et d’une papule ombiliquée a mis en évidence H.capsulatum var. duboisii. Après l’échec d’un traitement au fluconazole, l’évolution a été favorable sous l’amphotéricine B. La patiente a bénéficié de la collaboration Nord-Sud et de l’aide des structures sociales.
Conclusion: Cette observation nous a permis de décrire les particularités cliniques et socio-économiques, les difficultés diagnostiques et thérapeutiques d’un cas d’histoplasmose africaine disséminée et de démontrer encore l’efficacité de l’amphotéricine B.
Abstract
Introduction: Histoplasmosis due to Histoplasma capsulatum var. duboisii is a rare affection in Africa. Localized cutaneous lesions are the most common form. We report a disseminated form in an immunocompetent child.
Case report: An 8-year-old student has been hospitalized for generalized, cutaneous nodules associated with very severe osteo-articular pains of almost all the joints. The examination has noted a moderate acute malnutrition, multiple and sub-cutaneous nodules, pinkish and plan papules, umbilicate papules, very painful nodular tumefactions of several joints, multiple, firm and mobiles adenopathies, hepatosplenomegaly and secondary painful ulcerations. Multiple bones have been affected at the radiography. Histology of a cutaneous nodule and an umbilicate papule has identified H.capsulatum var. duboisii. After the failure of treatment with fluconazole, the evolution has been favourable with amphotericin B. The patient has benefited from collaboration North-South, the help of social structures.
Conclusion: This observation allowed us to describe clinical and socio-economic characteristics, diagnostic and therapeutic difficulties of a case of disseminated African histoplasmosis and has demonstrated the effectiveness of amphotericin B.
Mots-clé: Histoplasmose; africaine; disséminée; immunocompétent; enfant
Key words: Histoplasmosis; african; disseminated; immunocompetent; child
Introduction
L’histoplasmose est une mycose profonde due à un champignon, Histoplasma capsulatum qui possède deux variétés à savoir Histoplasma capsulatum var. capsulatum, agent de l’histoplasmose dite américaine (à tort, car de répartition mondiale) et Histoplasma capsulatum var. duboisii, agent de l’histoplasmose africaine. Ce sont des affections rarement décrites en Afrique. En effet, la fréquence réelle de la forme africaine n’est pas connue, la plupart des études ayant porté sur des cas cliniques [1-9]. Les lésions cutanées, qui sont les plus fréquentes, prédominent au thorax et à la face [5,10]. Les formes disséminées sont rares, et se rencontrent de plus en plus chez les patients immunodéprimés par le virus de l’immunodéficience humaine (VIH) [11,12]. Nous rapportons un cas d’histoplasmose africaine disséminée chez un enfant immunocompétent au Burkina Faso pour décrire les particularités cliniques et les difficultés socio-économiques, diagnostiques et thérapeutiques.
Observation
Une élève de 8 ans, de père cultivateur, est référée le 12 janvier 2010 pour des nodules cutanés, généralisés. Le début remonterait à 3 mois auparavant (octobre 2009) par un amaigrissement progressif, une anorexie et des douleurs ostéo-articulaires fixes, permanentes des grosses articulations (l’épaule, le coude et le poignet gauches, les genoux, la cheville gauche), à type de brûlure, exacerbées par la mobilisation, sans fièvre ni notion de traumatisme. Un mois plus tard, sont apparues des tuméfactions osseuses et articulaires du coude, de l’avant bras et du genou gauches et des deux jambes associées à des nodules cutanés, non prurigineux, indolores du dos puis disséminés à tout le corps. Les antécédents médicaux étaient sans particularités. L’interrogatoire notait dans son environnement habituel un important élevage traditionnel de poulets à domicile, et la fréquentation d’un abri de chauves-souris sur le trajet de l’école. L’examen à l’entrée a noté : un mauvais état général avec amaigrissement, une température à 37,2°C, un périmètre brachial à 15cm, un poids de 18kg, une taille de 124 cm (rapport poids/taille entre 75 et 80 %), ce qui traduisait une malnutrition aiguë modérée. L’examen dermatologique montrait trois types de lésions, disséminées à tout le tégument: des nodules sous cutanés, multiples, de 0,5 à 2 cm de diamètre, de consistance tantôt ferme tantôt fluctuante (abcès froids), indolores, mobiles par rapport au plan profond et cutané mais parfois adhérents à la peau ; ces nodules étaient associés à des papules rosées, arrondies ou ovalaires, de 3 à 5 mm, indolores, à surface plane, et à des papules ombiliquées (Fig. 1a, 1b). L’examen de l’appareil locomoteur avait noté des tuméfactions nodulaires (Fig. 2a, 2b), de 2 à 3 cm de diamètre, dures, très douloureuses du coude et l’avant-bras gauches, du poignet et du genou gauches et des jambes avec une attitude antalgique du membre supérieur gauche et une légère boiterie gauche à la marche. Il n’y avait pas de déformation visible au niveau du rachis. L’examen du système spléno-ganglionnaire a montré de multiples adénopathies fermes, mobiles, non inflammatoires, de 1,5 cm à 3 cm de diamètre, siégeant dans les régions sous angulo-maxillaires, axillaires et inguinales sans splénomégalie. Il n’y avait pas d’hépatomégalie. Nous avons évoqué une histoplasmose disséminée, une cryptococcose disséminée et une tuberculose multifocale. Les examens complémentaires montraient une vitesse de sédimentation accélérée (1ère heure = 84 mm), le fibrinogène élevé à 9,65 g/l, la CRP élevée à 198,9 mg/l), une anémie à 10,2 g/dl, normochrome, microcytaire, des ostéolyses multifocales péri articulaires notamment de l’acromion gauche, de la quasi-totalité de l’olécrâne gauche (Fig. 3a) et des régions métaphyso-épiphysaires des fémurs et des tibias (Fig. 3b, 3c) avec tuméfaction des parties molles en regard à la radiographie des articulations en janvier 2010; la radiographie pulmonaire et l’échographie abdominopelvienne étaient normales. L’intradermo-réaction à la tuberculine, la recherche de bacilles acido-alcoolo-résistants dans les crachats, la sérologie syphilitique (TPHA-VDRL) et celle pour le VIH étaient négatives. La glycémie, le bilan rénal et hépatique étaient normaux; l’électrophorèse de l’hémoglobine était AA.
.jpg) Figure 1a, 1b. Multiple nodules et papules ombiliquées siégeant au visage (a) et au dos (b) à l’admission (janvier 2010).
Figure 1a, 1b. Multiple nodules and umbilicate papules on the face (a) and the back (b) at entry (January 2010). |
.jpg) Figure 2a, 2b. Tuméfactions ostéo-articulaires du coude gauche (a) et du genou gauche (b) à l’admission (janvier 2010).
Figure 2a, 2b. Osteo-articular tumefactions of the left elbow (a) and the left knee (b) at entry (January 2010). |
.jpg) Figure 3a. Radiographie du coude gauche (de profil) : ostéolyse prenant la quasi-totalité de l’olécrâne gauche
avec réaction uni lamellaire postérieure à l’admission en janvier 2010. Figures 3b, 3c. Radiographie des genoux de face (3b) et de profil (3c). Ostéolyse métaphyso-épiphysaire intéressant les fémurs et les tibias à l’admission en janvier 2010. Figure 3a. Radiography of the left elbow (in profile): osteolysis of the quasi-totality of left olecranon with posterior unilamellar reaction at entry in january 2010. Figures 3b, 3c. Radiography of the knees from the front (3b) and in profile (3c). Metaphyso-epiphysial osteolysis concerning the femurs and the tibias at entry in january 2010. |
L’examen direct et la culture du pus d’un nodule, réalisés chez nous à l’hôpital, étaient négatifs. Les parents de notre patiente n’ayant pas les moyens financiers pour prendre en charge les frais de l’examen anatomopathologique, nous avons envoyé les échantillons de biopsie d’un nodule cutané et d’une papule ombiliquée à nos collaborateurs en France (l’examen fait gratuitement par l’anatomopathologiste Gilles Lemasson de Brest), ce qui a retardé la confirmation diagnostique et le traitement. Un traitement symptomatique a été institué (repos au lit, Paracétamol, Ibuprofène), avec la mise à plat de certains abcès, des pansements quotidiens avec des solutions antiseptiques. L’évolution au cours du premier mois d’hospitalisation (avant la confirmation du diagnostic) a été marquée par une intensification des douleurs ostéo-articulaires devenues insomniantes, ayant nécessité l’utilisation d’antalgiques de 2ème (tramadol par voie orale) puis de 3ème palier (morphine par voie injectable et orale) et la confection d’attelle plâtrée à visée antalgique des membres supérieur et inférieur gauches. L’histologie mettait en évidence un infiltrat cellulaire fait d’éléments histiocytaires qui comportaient de très nombreuses cellules géantes multinucléées, caractérisées par la présence dans leur cytoplasme de grandes levures typiques d’histoplasmose à H. capsulatum var. duboisii nettement colorable par l’HE (Fig. 4a), le PAS (Fig. 4b) et le Gomori-Grocott. Il n’y avait pas de parasites, ni d’éléments bactériens (coloration de Ziehl négatif). Le traitement étiologique au fluconazole injectable à raison de 200 mg/j (soit 11mg/kg/j) a effectivement débuté le 20 février 2010 après un bilan pré-thérapeutique normal. Cette molécule a été choisie du fait de sa disponibilité et de sa gratuité dans notre dépôt pharmaceutique à l’hôpital (l’amphotéricine B, l’itraconazole et le kétoconazole cités en première intention dans la littérature n’étaient pas disponibles et sont coûteux), de son coût (les parents de l’enfant n’avaient pas de moyens financiers), de ses moindres effets secondaires (notamment troubles gastro-intestinaux et hépatiques). Ce traitement a permis pendant 45 jours une stabilisation des lésions cutanées puis une aggravation est survenue, marquée par une exacerbation des douleurs ostéo-articulaires, une poussée de nouvelles lésions cutanées (Fig. 5) puis un ramollissement et une fistulisation simultanés de la quasi-totalité des nodules et des tuméfactions articulaires préexistantes aboutissant à des ulcérations douloureuses, bourgeonnantes (Fig. 6a, 6b). Par ailleurs, nous avons observé une hépatomégalie (FH à 12cm) indolore, ferme, à surface lisse et à bord mousse avec un bilan biologique normal et une splénomégalie de type I de Hackett. La prise en charge chirurgicale de certaines lésions sous anesthésie générale s’est avérée nécessaire en mi-avril 2010. En fin mai 2010, soit 3 mois après le début du fluconazole, nous avons constaté une aggravation des lésions radiologiques avec ostéolyse intéressant l’ulna et l’humérus gauches (Fig. 7a), le tibia, la fibula et le calcanéum gauches (Fig. 7b, 7c) avec un début de genu varum à gauche associée à des douleurs très intenses. Cliniquement, en fin juin, une deuxième poussée de lésions cutanées et ganglionnaires est survenue avec augmentation de la taille de l’hépato-splénomégalie. Nous avons décidé un changement d’antifungique. En effet, le 15 juillet 2010, malgré la crainte de sa toxicité, nous avons commencé le traitement à base d’amphotéricine B par voie injectable (commandé et obtenu gratuitement avec l’aide de la pharmacie de l’hôpital et des structures sociales), à dose progressive pour atteindre au bout de 3 jours, 15mg/j soit environ 0,8 mg/kg/j, 3 fois par semaine. L’évolution a été spectaculaire : en un mois de traitement, les ulcérations étaient presque toutes cicatrisées (Fig. 8a, 8b) avec la disparition quasi complète des nodules et des adénopathies, une régression de l’hépato-splénomégalie. Au 4ème mois de traitement, nous avons observé une nette régression des lésions osseuses radiologiques, et un gain pondéral de 2,500 kg. Une kinésithérapie douce a été alors associée au traitement.
.jpg) Figure 4a. HE x 400. Présence de grandes levures d’Histoplasma duboisii dans le cytoplasme de cellules géantes multinuclées.
Figure 4b. PAS x 400. Présence de très nombreuses levures d’Histoplasma duboisii, bien limitées par une capsule transparente. Figure 4a. HE x 400. Presence high yeasts of Histoplasma duboisii in the cytoplasm of giant multinuclear cells. Figure 4b. PAS x 400. Presence of very numerous yeasts of Histoplasma duboisii, well limited by transparent capsule. |
.jpg) Figure 5. Poussée de nodules au tronc et au membre supérieur droit sous fluconazole (juin 2010). |
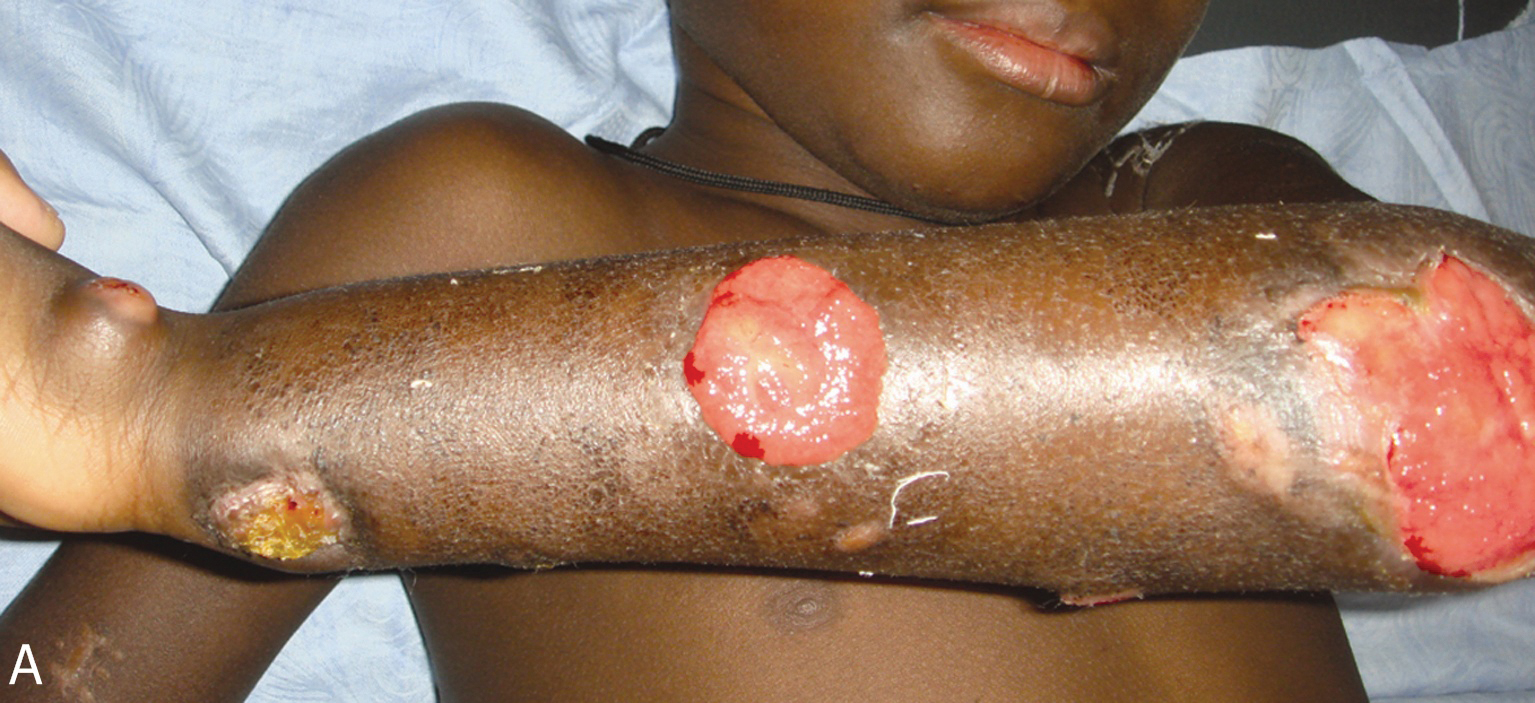 Figure 6a. Multiples ulcérations à l’avant bras gauche sous fluconazole (juin 2010).
Figure 6a. Multiples ulcerations on the left forearm during the treatment with fluconazole (June 2010). |
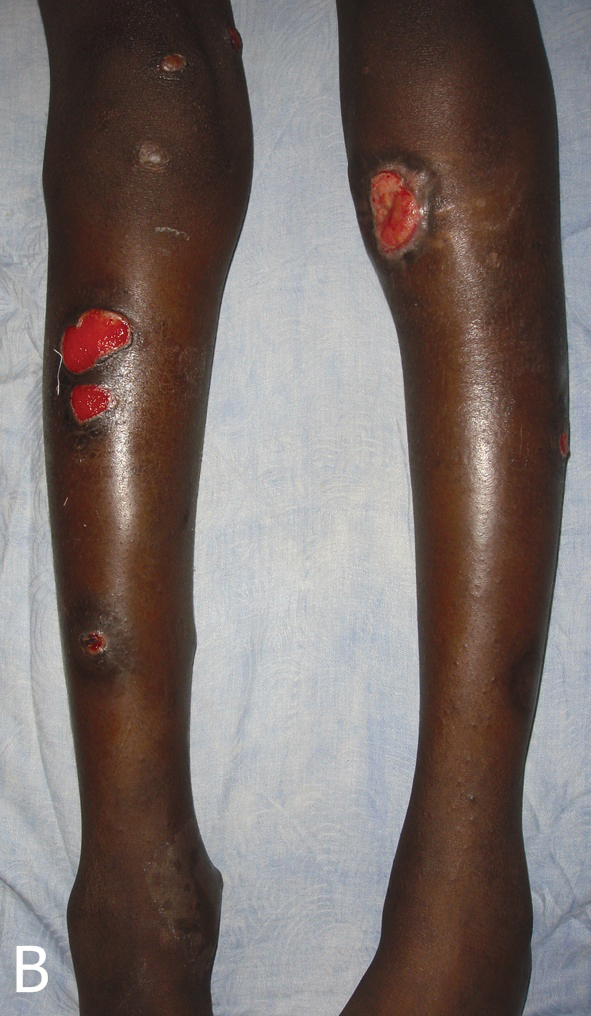 Figure 6b. Multiples ulcérations aux jambes sous fluconazole (juin 2010).
Figure 6b. Multiples ulcerations on the legs during the treatment with fluconazole (June 2010). |
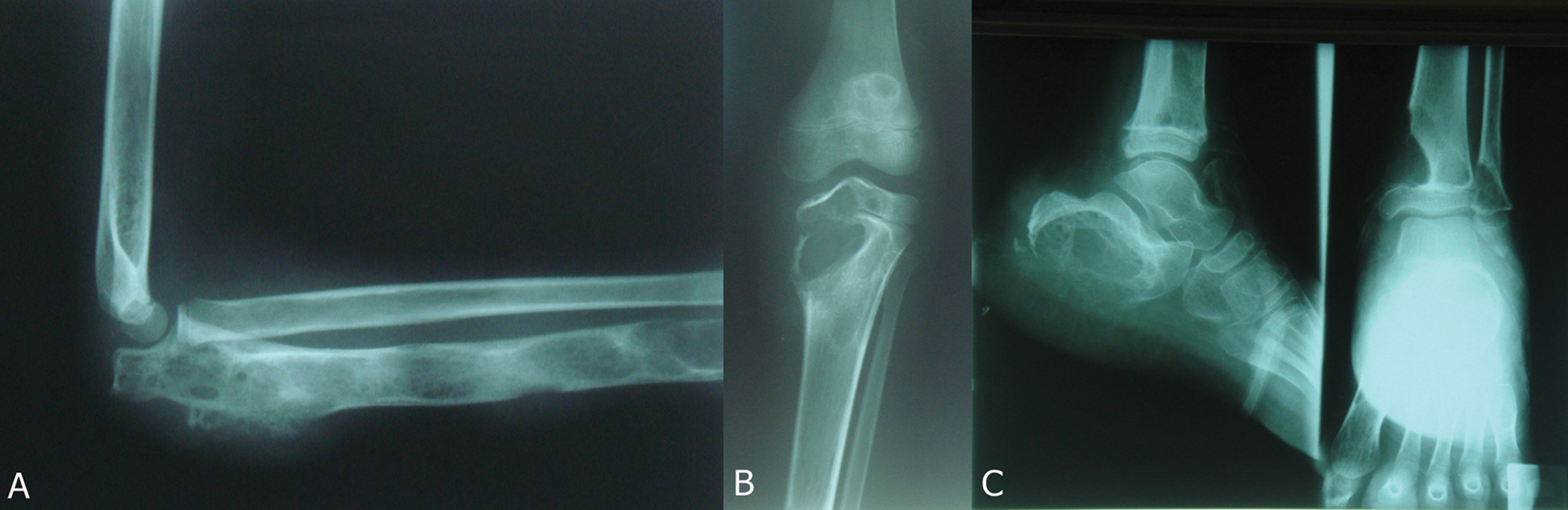 Figure 7a. Radiographie du coude gauche: Réaction périostée en poil de brosse de l’olécrâne et aspect remanié multi lacunaire de toute la diaphyse ulnaire en mai 2010 (sous fluconazole).
Figures 7b, 7c. Radiographie du genou gauche (a) et de la cheville gauche (b) en mai 2010: Majoration de l’ostéolyse métaphyso-épiphysaire supérieure et inférieure du tibia et de la fibula gauches, avec extension de l’ostéolyse à la patella et importante ostéolyse de type II du calcaneus sous fluconazole. Figure 7a. Radiography of left elbow: periosteal reaction of olecranon with multilacunar remodeled aspect of the whole ulnar diaphysis in may 2010 (treatment with fluconazole). Figures 7b, 7c. Radiography of left knee (a) and the left ankle (b) in may 2010: augmentation of the higher and lower metaphyso-epiphyseal osteolysis of the left tibia and the left fibula with extension of the osteolysis of the patella and important osteolysis of the calcaneum during the treatment with fluconazole. |
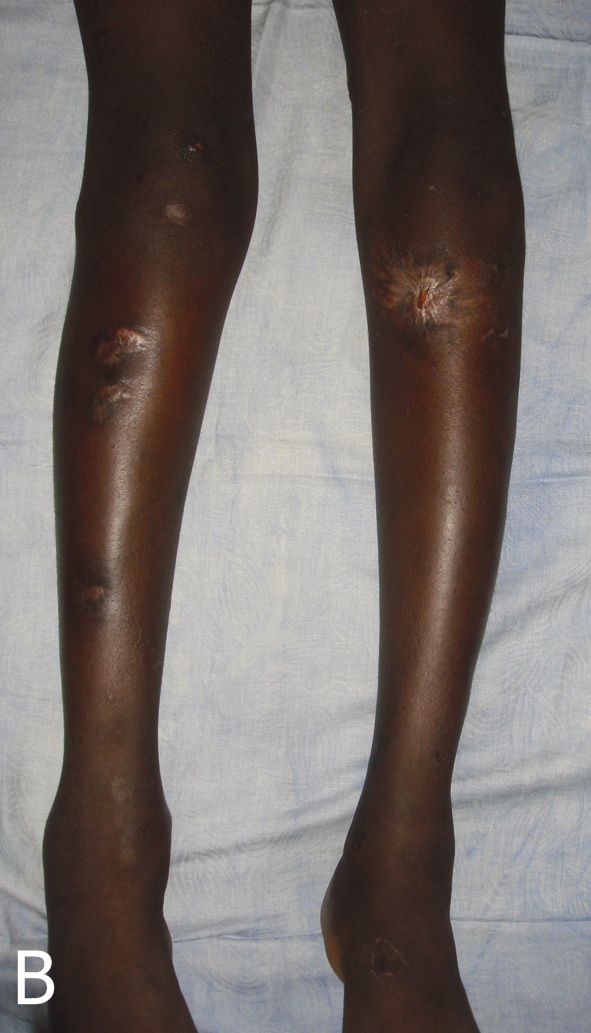
 Figures 8a, 8b. Lésions cicatricielles à l’avant bras gauche (a) et aux jambes (b) après un mois de traitement à l’amphotéricine B (aout 2010).
Figures 8a et 8b : Cicatricial lesions at the left forearm (a) and at the legs (b) after one month with amphotericin B treatment (August 2010) . |
 |
La tolérance clinique et biologique à l’amphotéricine B a été bonne (quelques effets secondaires à type de douleurs abdominales intenses, de fièvre et de frissons à la première semaine du traitement). Nous avons effectué une surveillance rigoureuse avec un bilan biologique bihebdomadaire (NFS, transaminases, ionogramme sanguin, urée, créatininémie) et parfois un électrocardiogramme. La mère et l’enfant ont bénéficié d’une psychothérapie. Nous avons réalisé le 7 mars 2011 un scanner du corps entier (les parents n’ayant pas les moyens financiers, il a été réalisé avec l’aide de structures sociales) pour rechercher d’autres atteintes et apprécier l’évolution des lésions osseuses radiologiques; il notait seulement la présence de multiples lésions lytiques résiduelles au niveau du squelette périphérique (Fig. 9a, 9b, 9c). Le 15 mars 2011, soit à 8 mois de traitement avec de l’amphotéricine B, cliniquement, toutes les lésions cutanées étaient cicatrisées (Fig. 10a, 10b), les adénopathies et l’hépato-splénomégalie avaient disparu. Devant la déviation des membres inférieurs en coup de vent (séquelles des lésions osseuses) composé d’un genou varum gauche et d’un genou valgum droit (Fig. 11a et 11b), le port diurne, mais surtout nocturne d’orthèses de correction a été prescrit, en attendant une éventuelle ostéotomie à froid. La dose cumulée de 2g d’amphotéricine B a été atteinte en fin mars 2011 et le relais pris en avril par le kétoconazole par voie orale (offert gratuitement) à raison de 100mg/jr (soit environ 5mg/kg/j) pour prévenir les récidives. Le patient a continué ce traitement pendant un mois puis l’a arrêté sans avis médical. Un bilan biologique effectué était normal. La surveillance clinique a été maintenue à cause du risque de récidives. En juillet 2012, soit un recul de 15 mois après l’arrêt du traitement, il n’y avait aucune récidive cliniquement mais l’enfant a été ensuite perdu de vue.
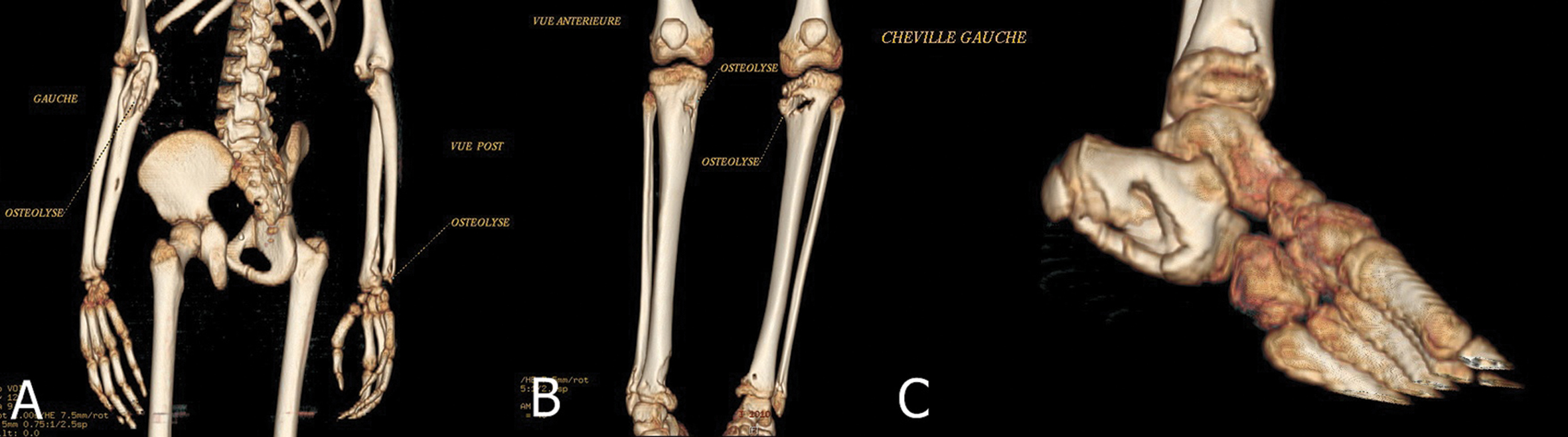 Figure 9a. Reconstruction osseuse en 3D à partir d’un bodyscan révélant les lésions résiduelles d’ostéolyse des os des avant- bras après 8 mois de traitement à l’amphotéricine B (mars 2011).
Figure 9b, 9c. Reconstruction osseuse en 3D montrant des lésions résiduelles d’ostéolyse des os de la jambe (b) et du calcaneus (c) après 8 mois de traitement à l’amphotéricine B (mars 2011). Figure 9a : Bony reconstruction in 3D with bodyscan showing residual osteolysis of the bone of the forearms after 8 months of amphotericin treatment (March 2010). Figure 9b, 9c. Bony reconstruction in 3D with bodyscan showing residual osteolysis of the bone of the legs after 8 months of amphotericin treatment (March 2010). |
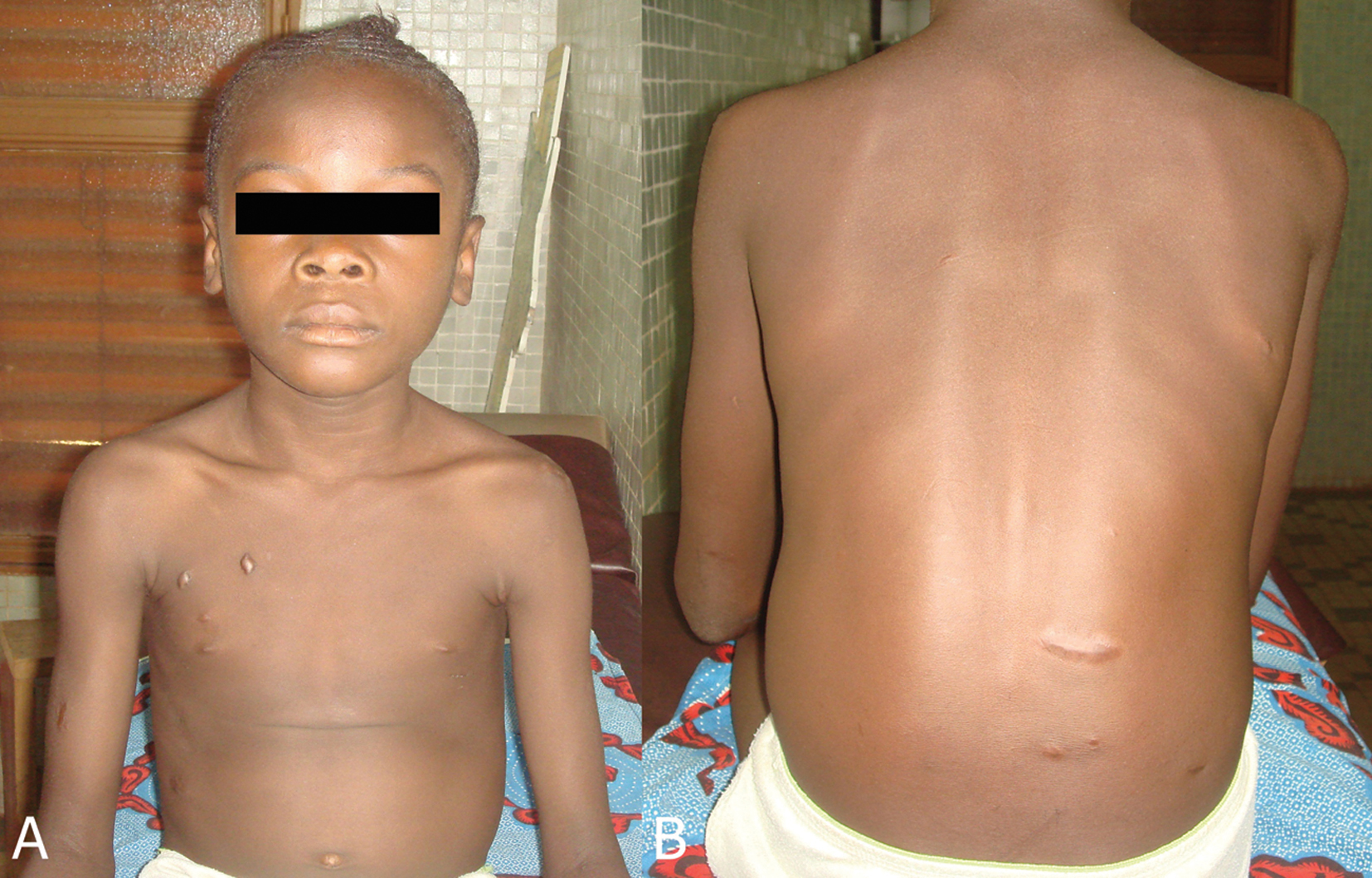 Figure 10a, 10b. Disparition complète des lésions cutanées (du visage et du tronc) de face (a) et de dos (b), après 8 mois de traitement à l’amphotéricine B en mars 2011. Noter les cicatrices hypertrophiques à la poitrine et au dos
Figure 10a et 10b : complete disparition of cutaneous lesions (face and trunk) in front (a) and the back (b) after 8 months of amphotericin treatment (March 2010). |
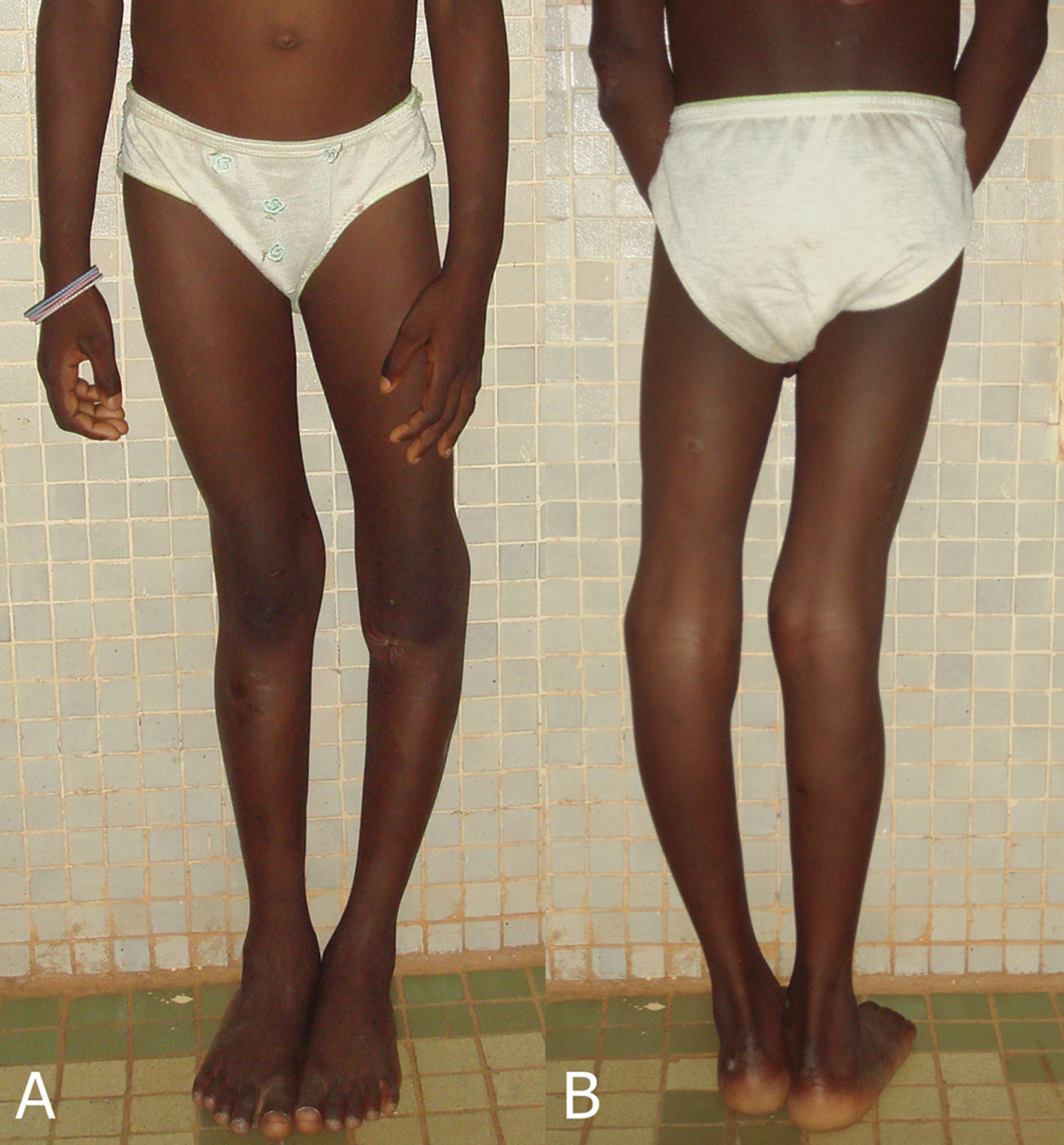 Figure 11a, 11b. Déviation des membres inférieurs : genu varum à gauche, et genu valgum à droite de face (a) et de dos (b) en mars 2011.
Figure 11a, 11b. Deviation of the lower limbs : genu varum at the left and genu valgum at the right in front (a) and on the back (b) in March 2011. |
Discussion
L’histoplasmose africaine demeure encore une affection rare en dehors de quelques foyers dans certains pays d’Afrique [13]. Au Burkina Faso, à notre connaissance selon la littérature, nous rapportons le 9ème cas publié mais nous n’avons pas trouvé d’observation sur les six premiers cas. Les 2 derniers cas étaient des enfants comme le nôtre [1,2] alors que l’histoplasmose africaine prédominerait chez les adultes jeunes. En Afrique, d’autres cas ont été décrits chez des enfants immunocompétents [1-9]. La prédominance masculine est notée dans la littérature [10] avec un sex-ratio variant entre 2 et 3 mais notre cas est une fille. Contrairement à l’histoplasmose américaine, la porte d’entrée de l’histoplasmose africaine fait toujours l’objet de débat. Dans notre cas, la voie aérienne pourrait être incriminée compte-tenu de l’environnement de l’enfant où le père avait un important élevage de poulets à domicile, et de la fréquentation d’un arbre qui était un abri de chauve-souris (sur le trajet de l’école) mais il n’y avait pas d’atteinte pulmonaire; l’affection ayant commencé par des douleurs ostéo-articulaires puis les nodules articulaires et cutanés, la voie transcutanée pourrait être privilégiée; l’analyse du sol de son environnement par un laboratoire d’analyse mycologique qualifié aurait été d’un grand apport. Calzolari et al [1], Vieira et al [14] et Arlet et al [15] ont incriminé respectivement la voie aérienne, la voie transcutanée et la voie digestive chez leurs patients. Bien que les lésions soient souvent localisées, des formes disséminées ont été décrites chez des enfants par d’autres auteurs [1,3,9,10,16] mais notre patiente avait une forme multifocale disséminée d’histoplasmose africaine associant une localisation cutanée généralisée, ostéo-articulaire multiple, pluri-ganglionnaire, hépatique et splénique. Le polymorphisme des lésions cutanées a été décrit par d’autres auteurs [2,6,8,10]. En effet, notre patiente avait des nodules, des lésions de pseudo-molluscum contagiosum, des papules planes, des abcès froids, des ulcérations bourgeonnantes mais notre cas était particulier par la diffusion et la multiplicité des lésions sur tout le corps, y compris le cuir chevelu et les paupières. Les lésions osseuses étaient particulières par les douleurs très intenses et par l’atteinte multifocale (plusieurs os et articulations atteints) entrainant une déformation des membres. Les ulcérations cutanées et les lésions ostéo-articulaires étaient si douloureuses que nous avons été obligés de prescrire de la morphine. Bien qu’ayant noté des lésions cutanées au visage et au niveau du cuir chevelu, nous n’avons pas observé de lésions osseuses du crâne, ni de la face chez notre patiente. Toutefois, selon Simon [17], les os de la face sont des sièges électifs (14,4%) d’histoplasmose africaine chez les enfants et les jeunes patients. L’hépato- splénomégalie pourrait être aussi due à un envahissement du foie et de la rate par la mycose chez notre fillette car elle n’était pas présente à l’admission et a régressé au cours du traitement par l’amphotéricine B; cette atteinte hépatique pourrait expliquer l’anorexie et l’amaigrissement progressif. Nous n’avons pas pu effectuer la ponction-biopsie du foie pour y rechercher H.capsulatum var. duboisii du fait du manque de moyens financiers du patient et du risque encouru, notre plateau technique étant limité. Les localisations viscérales dans l’histoplasmose africaine sont rares [14,15] et d’une extrême gravité, avec une évolution souvent fatale surtout dans sa localisation hépatosplénique [18]. Nous n’avons pas observé d’atteinte pulmonaire; en effet, elle est rare dans l’histoplasmose africaine [1]. Le diagnostic chez notre patiente a été posé à partir de l’examen anatomopathologique de deux prélèvements cutanés. L’examen direct et la culture du pus, réalisés chez nous à l’hôpital, étaient négatifs ; cela retarde le diagnostic et le traitement, et témoigne des difficiles conditions de travail dans notre pays. Concernant le traitement, Onwuasoigwe [19] suggérait l’utilisation du fluconazole dans le traitement de l’histoplasmose du fait de sa meilleure tolérance et de sa facilité d’administration par voie orale. Cependant, dans notre cas, nous avons eu un échec avec le fluconazole; la patiente a eu au cours du traitement (qui a duré 4 mois et trois semaines) deux épisodes de poussées de lésions cutanées et ganglionnaires, une aggravation des lésions osseuses et l’apparition d’une hépatosplénomégalie. Par contre, grâce à une bonne tolérance clinique et biologique, l’amphotéricine B a prouvé une efficacité remarquable chez notre patiente dès la deuxième semaine de traitement, avec une rémission clinique quasi complète au bout de 8 mois. L’efficacité de l’amphotéricine B a été prouvée par de nombreux auteurs, notamment par Vieira et al [13], Arlet et al [15] et Garcia-Guiñon et al [6]. Cependant, quelques cas de rechutes et de toxicité, voire de décès [7] liées à cette molécule ont été décrits. L’évolution a été favorable dans notre cas mais le traitement a duré 8 mois alors qu’il est normalement de 4 mois [10]. Le coût de ces molécules reste hors de portée de la plupart de nos populations dans notre pays comme en témoignent d’autres auteurs africains [9]. Ce manque de moyens financiers expliquait le retard à la consultation, fréquent dans nos régions, du diagnostic et celui du traitement à l’amphotéricine B qui n’était pas disponible au dépôt pharmaceutique de notre hôpital ; en effet, notre patiente a bénéficié pour sa prise en charge, de l’aide de structures sociales et de notre dépôt pharmaceutique, de la gratuité du fluconazole dans notre pays. Nous avons eu recours aux chirurgiens pour le parage des lésions cutanées fistulisées et pour la correction des déformations osseuses. La prise en charge de notre patiente a été donc multidisciplinaire (médicale, chirurgicale, orthopédique et psycho-sociale). La déformation des membres constituait un préjudice fonctionnel et moral (la patiente affirmait être la cible de moqueries de ses camarades d’école) qui pourrait jouer sur les résultats scolaires de l’enfant. Le pronostic vital est toujours réservé compte-tenu du risque de récidives tardives voire de décès dans les formes viscérales d’histoplasmose africaine ; une surveillance à long terme de cette patiente s’imposait, ce qui s’avérait difficile du fait qu’elle résidait dans une autre localité éloignée de notre hôpital. Chez notre patiente, la sérologie pour le VIH était négative. S’il est établi que l’histoplasmose disséminée à Histoplasma capsulatum var. capsulatum est considéré comme « un bon marqueur » de l’immunodépression due au VIH, le cas de l’histoplasmose à Histoplasma capsulatum var. duboisii n’est pas encore élucidé [20]. La malnutrition aiguë modérée chez notre patiente pourrait diminuer ses défenses immunitaires, expliquant cette contagion par cette mycose. La prévalence réelle de l’histoplasmose africaine est sous-estimée du fait de sa rareté en dehors des zones d’endémie, du retard au diagnostic (polymorphisme clinique occasionnant la confusion avec la tuberculose), du décès souvent rapide des patients (manque de moyens financiers, inaccessibilité géographique aux hôpitaux), du plateau technique limité dans notre pays, et l’inaccessibilité au test du VIH dans les zones rurales.
Conclusion
L’histoplasmose africaine est rare chez le patient immunocompétent au Burkina Faso. Cette observation nous a permis d’identifier chez le même patient, les différentes manifestations de cette affection. Ainsi, nous avons noté l’atteinte de plusieurs appareils (la peau, les ganglions, les os, le foie et la rate), le polymorphisme des lésions cutanées, la diffusion des lésions et le caractère très douloureux des lésions osseuses, le retard à la consultation et les problèmes financiers qui ne permettent pas de confirmer nos diagnostics précocement. Ce cas nous a prouvé que le fluconazole n’est pas toujours efficace et que l’amphotéricine B reste le traitement de choix dans nos pays à moyens limités.
REFERENCES
1. Calzolari M, Schutz R, Zango B, Mateo J: [Disseminated african histoplasmosis with pulmonary lesions. About a just observed case in bobo-dioulasso (burkina-faso)]. Med Mal Infect. 1990;20:252-54.
2. Goumbri/Lompo OM, Sanou/Lamien AM, Barro/Traoré F: Histoplasmose à Histoplasma capsulatum var duboisii: à propos d’un cas au CHU Pédiatrique Charles de Gaulle de Ouagadougou. Annales de l’Université de Ouagadougou. 2005;3(série D):1-11.
3. Pitche P, Dossim A, Mijiyawa M, Napo-Koura G, Tchangaï-Walla K: [Multiple bone lesions of a type of disseminated African histoplasmosis in a Togolese immunocompetent child]. Rev Chir Orthop. 1995;81:745-48.
4. Daubenton JO, Beatty OW: Disseminated histoplasmosis in an immunocompetent child. S Afr Med J. 1998;88:270-71.
5. Ahogo KC, Sangaré A, Gbery IP, Ecra E, Kaloga M, Kassi K, et al: [Cutaneous histoplasmosis due to Histoplasma capsulatum variety duboisii in an immune competent child. About one case in Abidjan, Côte d’Ivoire]. Bull Soc Pathol Exot. 2009;102:147-49.
6. Garcia-Guiñon A, Torres-Rodríguez JM, Torangar Ndidongarte D: Disseminated histoplasmosis by Histoplasma capsulatum var. duboisii in a paediatric patient from the Chad Republic, Africa. Eur J Clin Microbiol Infect Dis. 2009;28:697–99.
7. Rakotoarivelo RA, Razafimahefa SH, Andrianiaina HD, Randria MJ: [African histoplasmosis in an immunocompetent Malagasy patient]. Bull Soc Pathol Exot. 2010;103:19-21.
8. Okoko AR, Ekouya Bowassa G, Oko APG, Gathse A, Mapapa-Miakassissa RCL, Mbika-Cardorelle A, et al: Histoplasmose généralisée chez un enfant immunocompétent au VIH. Med Afr Noire. 2010;57:590-92.
9. Minta DK, Dembélé M, Lorre G, Diallo DA, Traoré HA, Chabasse D: [African histoplasmosis (Histoplasma capsulatum var. duboisii): a case report from Mali]. Sante. 2005;15:195-99.
10. Piérard G-E, Quatresooz P, Piérard-Franchimont C: Mycoses. In Saurat J-H, Lachapelle J-M, Lipsker D, Thomas L eds. Dermatologie et infections sexuellement transmissibles. Paris. Masson. 5e édition;2008:185.
11. Pellaton C, Cavassini M, Jaton-Ogay K, Carron PN, Christen-Zaech S, Calandra T, et al: Histoplasma capsulatum var. duboisii infection in a patient with AIDS: rapid diagnosis using polymerase chain reaction. Diagn Microbiol Infect Dis. 2009;64:85–9.
12. Sangaré A, Yoboué P, Ahogo C, Ecra E, Kaloga M, Gbery I, et al: [Disseminated cutaneous histoplasmosis due to Histoplasma capsulatum var. duboisii associated with AIDS. A case report in Abidjan, Côte d’Ivoire]. Bull Soc Pathol Exot. 2008;101: 5-7.
13. Gugnani HC, Muotoe-Okafor F: African histoplasmosis: a review. Rev Iberoam Micol. 1997;14:155-59.
14. Vieira R, Botelho MM, Lima C, Lázaro A, Martins ML: Intra-abdominal abscess: A clinical manifestation of African histoplasmosis. J Mycol Med. 2009;19:134-37.
15. Arlet JB, Furco-Mazzantini A, Huerre M, Neuville S, Molina JM: African Histoplasmosis Infection with Peritoneal Involvement. Eur J Clin Microbiol Infect Dis. 2004;23:342–44.
16. Garcia-Guiñon A, Torres-Rodríguez JM, Torangar Ndidongarte D: Disseminated histoplasmosis by Histoplasma capsulatum var. duboisii in a paediatric patient from the Chad Republic, Africa. Eur J Clin Microbiol Infect Dis. 2009;28:697–99.
17. Simon F, Chouc PY, Hervé V, Branquet D, Jeandel P: [Bone and joint sites of African histoplasmosis (Histoplasma duboisii). Apropos of a case and review of the literature]. Rev Rhum. 1994;61:829-38.
18. Gugnani HC, Muotoe-Okafor F: African histoplasmosis: a review. Rev Iberoam Micol. 1997;14:155-59.
19. Onwuasoigwe O: Fluconazole in the therapy of multiple osteomyelitis in African histoplasmosis. Int Orthop. 1999;23:82–4.
20. Loulergue P, Bastides F, Baudouin V, Chandenier J, Mariani-Kurkdjian P, Dupont B, et al: Literature review and case histories of Histoplasma capsulatum var. duboisii infections in HIV-infected patients. Emerg Infect Dis. 2007;13:1647–52.
Comments are closed.