Les toxidermies au service de Dermatologie-MST du CHU de Conakry (Guinée): responsabilité des antirétroviraux
[Cutaneous drug reactions in the Dermatology-STD department of the University Hospital of Conakry (Guinea): responsibility of antiretroviral drugs]
Mohamed Maciré Soumah 1, Moussa Keita1, Thierno Mamadou Tounkara1, Boh Fanta Diane1, Marguerite Bombo Bangoura1, Fodé Bangaly Sako2, Fatimata Keita1, Moussa Savane1, Mamadou Diouldé Kante1, Mohamed Cisse1
1, Moussa Keita1, Thierno Mamadou Tounkara1, Boh Fanta Diane1, Marguerite Bombo Bangoura1, Fodé Bangaly Sako2, Fatimata Keita1, Moussa Savane1, Mamadou Diouldé Kante1, Mohamed Cisse1
1Department of Dermatologie-STD, CHU Donka, Université Gamal Abdel Nasser de Conakry, Guinea, 2Department of Infectious and Tropical Deseases, CHU Donka, Université Gamal Abdel Nasser de Conakry, Guinea
Citation tools:
Copyright information
© Our Dermatology Online 2022. No commercial re-use. See rights and permissions. Published by Our Dermatology Online.
ABSTRACT
Background: Antiretroviral (ARV)-induced toxidermia is increasingly reported. They most often complicate ARV therapy and can compromise the therapeutic future of patients living with HIV. The aim of this study was to determine the frequency of ARV-induced toxidermia, to identify the ARVs responsible, to describe the clinical forms encountered and the evolutionary modalities of patients.
Material and methods: This was a cross-sectional study from January 2000 to December 2018. The study consisted in identifying and documenting all cases of ARV-induced toxidermia during the study period at the Dermatology-IST department of the University Hospital of Conakry. Internationally accepted diagnostic criteria were used for diagnosis. Accountability was based on the Begaud criteria.
Results: We recorded 47/198 (23.7%) cases of ARV-induced toxidermia during the period. The mean age of the patients was 35.02± 1.60 with extremes of 23 and 61 years. The sex ratio was 0.7. The toxidermia encountered were Stevens-Johnson syndrome (SJS) in 22/47 (46.8%) cases, toxic épidermal necrolysis (TEN) in 8/47 (17%) cases, overlap syndrome between SJS and TEN in 1/47 (2.1%) cases, maculo-papular exanthema in 10/47 (21.3%) cases, urticaria in 4/47 (8.5%) cases and erythema pigmentum fixans in 2/47 (4.3%). The ARVs involved were nevirapine in 44/47 (93.6%) cases and efavirenz in 3/47 (6.4%) cases. We recorded 8/44 (17%) deaths.
Conclusion: The occurrence of toxidermia during antiretroviral therapy is a major challenge. Therefore, ARVs with a high risk of toxidermia should be removed from the ARV regimens offered to patients.
Key words: Toxidermia; Antiretrovirals; HIV; Conakry
RÉSUMÉ
Introduction: Les toxidermies induites par des antirétroviraux (ARV) sont de plus en plus rapportées. Elles compliquent le plus souvent le traitement antirétroviral et peuvent compromettre l’avenir thérapeutique des patients vivant avec le VIH. Le but de cette étude était de déterminer la fréquence des toxidermies induites par ARV, d’identifier les ARV responsables, de décrire les formes cliniques rencontrées et les modalités évolutives des patients.
Matériel et méthodes: Il s’agissait d’une étude transversale rétrospective allant de janvier 2000 à décembre 2018. L’étude a consisté à recenser et à documenter tous cas de toxidermies induites par les ARV durant la période d’étude au service de Dermatologie-MST du CHU de Conakry. Les critères diagnostiques internationalement admis étaient utilisés pour le diagnostic. L’imputabilité était basée sur les critères de Begaud.
Résultats: Nous avons récencé 47/198 (23,7%) cas de toxidermies imputées aux ARV durant la période. L’âge moyen des patients était 35,02± 1,60 avec des extrêmes de 23 et 61 ans. Le sex-ratio était de 0,7. Les toxidermies rencontrées étaient à type de syndrome de Stevens-Johnson dans 22/47 (46,8 %) cas, de syndrome de Lyell dans 8/47 (17 %) cas, de syndrome de chevauchement entre le SSJ et la NET dans 1/47 (2,1 %), l’exanthème maculo-papuleux dans 10/47 (21,3 %) cas, d’urticaire dans 4/47 (8,5 %) cas et d’érythème pigmenté fixe dans 2/47 (4,3 %). Les ARV incriminés étaient la névirapine dans 44/47 (93,6 %) cas et l’efavirenz dans 3/47 (6,4 %) cas. Nous avons enregistré 8/44 (17 %) décès.
Conclusion: La survenue des toxidermies au cours du traitement antirétroviral est un défi majeur. C’est pourquoi les ARV à haut risque de toxidermie devraient être retirés des régimes ARV proposés aux patients.
Mots clés: Toxidermies; Antirétroviraux; VIH; Conakry
INTRODUCTION
Les toxidermies sont des complications cutanéomuqueuses secondaires à l’administration des médicaments administrés par voie systémique [1].
Elles sont les plus fréquents des effets indésirables des medicaments, notifiés aux centres de pharmacovigilance (environ 20 % des notifications spontanées d’accidents médicamenteux). Elles compliquent 2 à 3 % des traitements hospitaliers et motivent 1 % des consultations et 5 % des hospitalisations en dermatologie [2].
Leur incidence est relativement plus élevée au cours de l’infection par le virus de l’immunodéficience humaine (VIH) que dans la population générale [3,4].
Pendant longtemps chez ces malades, ces toxidermies étaient dues principalement aux sulfamides anti-infectieux utilisés pour traiter ou prévenir les infections opportunistes [5,6].
Mais depuis l’avènement des multithérapies antirétrovirales (ARV), il existe un risque supplémentaire de toxidermie liée à la toxicité de certains de ces médicaments [7,8].
En effet, ces ARV ont complètement modifié l’histoire naturelle de cette infection par le VIH, la transformant d’une maladie létale en une maladie chronique nécessitant un suivi au long court. Ce qui a permis dans tous les pays de réduire de façon drastique la morbidité et la mortalité liée au VIH.
Cependant, la survenue des toxidermies au cours du traitement ARV complique le plus souvent le traitement et peut compromettre l’avenir thérapeutique des patients vivant avec le VIH [9].
C’est pourquoi, après plus de trois décennies de prise en charge des patients vivant avec le VIH en Guinée, nous avons choisi d’évaluer la responsabilité des ARV dans la survenue des toxidermies en Guinée, d’identifier les ARV responsables, de décrire les formes cliniques de toxidermie rencontrées et les modalités évolutives des patients atteints de toxidermies sous ARV.
PATIENTS ET MÉTHODES
Il s’agissait d’une étude transversale rétrospective de type descriptif allant de janvier 2000 à décembre 2018, portant sur tous les cas de toxidermie induite par les ARV, observés au service de Dermatologie-MST du CHU de Conakry. L’étude a consisté à recenser et à documenter tous les cas de toxidermies induites par les ARV durant la période d’étude.
Nous avons inclus dans cette étude: les patients de tout âge, de tout sexe et de toute provenance, infectés par le VIH, quel que soit le sérotype et le stade clinique OMS, ayant développés une toxidermie imputée aux ARV, quelque soit la forme clinique, cliniquement diagnostiquée et compatible avec la description clinique donnée dans le dossier médical. Les critères diagnostiques internationalement reconnus ont été également utilisés pour certaines formes [10,11].
Les 16 cas de toxidermies induites par les ARV déjà publiés par notre service ont également été inclus [12].
Les critères d’imputabilité utilisés pour retenir la responsabilité des ARV étaient celle de Bégaud [13].
Nous avons étudier les variables sociodémographiques (âge, sexe, provenance), cliniques (antécédent, délai de survenue de la toxidermie, type de toxidermie, stade clinique OMS des patients), paracliniques (sérotype de VIH, taux de CD4), thérapeutiques (ARV responsables) et évolutives (durée d’hospitalisation, issue de l’évolution).
Les données ont été recueillies sur des fiches d’enquête, saisies dans les logiciels Word et Excel puis analysées sur le logiciel SPSS dans sa version 20.
Cette étude a été approuvée par le comité éthique de la faculté de Médecine de l’université Gamal Abdel Nasser de Conakry.
RÉSULTATS
Nous avons récencé 47/198 (23,7 %) cas de toxidermies imputées aux ARV durant la période d’étude. L’âge moyen des patients était 35,02± 1, 60 avec des extrêmes de 23 et 61 ans. Nous avons noté une prédominance féminine avec un sex-ratio (H/F) de 0,7. Le tableau 1 récapitule les caractéristiques sociodémographiques de notre série.
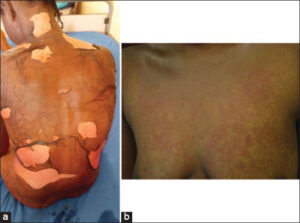
Sur le plan clinique, la majorité des toxidermies 32/47 (68,1 %) est survenue entre 7 et 21 jours après le début des ARV; les toxidermies rencontrées étaient à type de syndrome de Stevens-Johnson (SSJ) dans 22/47 (46,8 %) cas, de nécrolyse épidermique toxique (NET) (ou syndrome de Lyell) dans 8/47 (17 %) cas, de syndrome de chevauchement entre le SSJ et la NET dans 1/47 (2,1 %) cas (Fig. 1a), d’exanthème maculo-papuleux dans 10/47 (21,3 %) cas (Fig. 1b), d’urticaire dans 4/47 (8,5 %) cas et d’érythème pigmenté fixe dans 2/47 (4,2 %) cas. Il s’agissait souvent de patients classés aux stades avancés du VIH (stade III et IV de l’OMS) dans 28/47 (59,6 %) des cas. Le tableau II récapitule les caractéristiques cliniques des patients.
Sur le plan paraclinique, tous les patients étaient infectés par le VIH 1; ils avaient un taux de CD4 inférieur à 500/mm3 dans 30/47 (63,8 %) des cas.
Sur le plan étiologique, les inhibiteurs non nucléosidiques de la transcriptase inverse étaient les ARV incriminés, dont la névirapine dans 44/47 (93,6 %) cas et l’efavirenz dans 3/47 (6,4 %) cas.
Sur le plan évolutif, la durée moyenne d’hospitalisation était de 18,5 jours avec des extrêmes de 7 et de 30 jours; la majorité des patients a évolué favorablement vers une guérison sans séquelle dans 39/47 (83 %), nous avons enregistré 8/47 (17 %) décès.
DISCUSSION
Nous avons réalisé une étude transversale rétrospective de type descriptif, allant de 2000 à 2018 afin de documenter les toxidermies dues aux ARV. Le caractère rétrospectif de cette étude ne nous a pas permis de cerner tous les aspects de ce problème. Néanmoins les résultats obtenus permettent de situer la responsabilité des ARV dans la survenue des toxidermies dans le service de Dermatologie-MST du CHU de Conakry.
Avec une fréquence de 23,7 %, notre étude confirme la fréquence élevée des toxidermies induites par les ARV, comme rapporté par d’autres auteurs notamment Pitché P et al. [4] qui ont trouvé une fréquence de près de 14 %. Nos résultats pourraient s’expliquer par la présence de la névirapine dans les régimes d’ARV longtemps proposés aux PVVIH dans notre pays. Néanmoins, cette tendance a changé par le retrait progressif de cette molécule dans les protocoles ARV utilisés en Guinée.
Les caractéristiques sociodémographiques de notre série sont celles des patients jeunes à majorité de sexe féminin comme rapporté par d’autres études notamment celles de Kourouma S et al. [14] en Côte d’Ivoire et de Diop A et al. [15] au Sénégal. Ce profil est celui classiquement observé au cours de l’infection par le VIH en Afrique avec des patients vus au stade avancé de l’infection comme illustré par notre étude où la majorité des cas était reçu au stade III et IV de l’OMS. Ceci a pour conséquence une prise en charge difficile des patients, qui va être amplifié par la survenue de situation grave comme des toxidermies, pouvant compromettre l’avenir thérapeutique des patients. En outre, le sexe féminin est le facteur de risque fréquemment trouvé dans la plupart des études aussi bien rétrospectives que prospectives avec un risque augmenté de 2 à 16,5 selon les auteurs [16–18]. En effet, généralement la femme fait plus de toxidermie que l’homme et ceci avec les principaux médicaments à haut risque [4].
Ainsi, Bersoff-Matcha et al. [16] dans une étude multicentrique, et en analyse multivariée trouvaient que la femme avait 7 fois plus de risque de développer une toxidermie sévère que l’homme. Ce risque était de 4 dans la série d’Antinori et al. [17] et de 5 dans celle de Mazhude et al. [18]. Mais dans les séries de Launay et al. [19] et de Knobel et al. [20], cette variable n’était pas associée aux toxidermies.
Comme illustré dans notre étude, les antécedents de toxidermies prédisposeraient les malades infectés par le VIH à développer une toxidermie aux ARV en général et à la névirapine en particulier. Les allergies aux sulfamides et à l’abacavir sont les plus documentées [21]. Pour certains auteurs un taux de CD4 < 100 mm3 augmenterait le risque de toxidermie [22], pour d’autres c’est le contraire [16,23].
Sur le plan clinique, nous avons noté une prédominance des formes sévères à type de SSJ/NET (66 %), contrairement à la série de Diop A et al. [15] au Sénégal qui ont rapporté une prédominance des formes bénignes à type d’exanthème maculopapuleux dans 61,4 %; Konaré HD et al. [24] au Mali ont rapportés 30,6 % d’érythème pigmenté fixe. La prédominance des formes graves dans notre étude pourrait s’expliquer en partie par le mode de recrutement des patients, qui ont été vus surtout en hospitalisation.
La responsabilité de la névirapine dans la survenue des toxidermies sous ARV a été largement documentée. Selon les données de la littérature, la fréquence des toxidermies dues à la névirapine varie entre 10 à 35 % [7,25–27].
Dans une méta-analyse des différentes cohortes sous névirapine, la fréquence des toxidermies, quelle que soit la gravité, était estimée à 35 % chez 380 malades traités par névirapine contre 19 % dans le groupe contrôle [28]. Dans la même population, les toxidermies étaient sévères dans 6,6 % dans le groupe névirapine contre 1,9 % dans le groupe contrôle. Si dans la majorité des cas les toxidermies induites par la névirapine sont bénignes et restent largement dominées par les exanthèmes maculopapuleux, la fréquence des toxidermies sévères n’est pas négligeable [8,29,30]. Le risque de SSJ/NET chez les malades traités par névirapine est de 0,3 % [8]. La fréquence des toxidermies graves due à la névirapine varie donc selon les auteurs.
Sur le plan évolutif, les décès sont dus surtout aux formes graves comme le confirme notre étude où tous les cas de NET sont décédés. Cette mortalité due à la NET peut atteindre 20 % selon les séries [15]. Ceci pourrait s’expliquer par le retard de la prise en charge d’une part et d’autre part par le manque d’une structure de soins intensif adapté dans la prise en charge de ces formes graves, ce qui définit la gravité de cette entité qui compromet le pronostic vital par des désordres hydro-électrolytique, le risque d’infection et l’importance du décollement cutanés.
CONCLUSION
Notre travail montre que les antiretroviraux occupent une place importante dans la survenue des toxidermies dans notre contexte. Il s’agit souvent de formes graves survenant en majorité chez les femmes infectées par le VIH, au stade avancé de l’infection. Les inhibiteurs non nucléosidiques de la transcriptase inverse, notamment la névirapine et l’efavirenz étaient les ARV incriminés.
La survenue de ces toxidermies au cours du traitement ARV constitue donc un défi majeur pour l’équipe soignante. C’est pourquoi les ARV à haut risque de toxidermie devraient être retirés des régimes ARV proposés aux patients.
Déclaration des droits de l’homme et des animaux
Toutes les procédures étaient conformes aux normes éthiques du comité responsable de l’expérimentation humaine (institutionnel et national) et à la déclaration d’Helsinki de 1975, telle que révisé en 2008.
Déclaration de consentement
Le consentement éclairé a été obtenu des deux parents du nourrisson pour la publication de cette observation.
RÉFÉRENCES
1. Barbaud A. Prise en charge globale des toxidermies. Ann Dermatol Venereol. 2007;134:391-401.
2. Valeyrie-Allanore L, Sassolas B, Roujeau JC. Drug-induced skin, nail and hair disorders. Drug Saf. 2007;30:1011-30.
3. Coopman SA, Johnson R, Platt R, Stern RS. Cutaneous diseases and drug reactions in HIV infection. N Engl J Med. 1993;328:1670-4.
4. PitchéP, Drobacheff-Thiebaut C, Gavignet B, Mercier M, Laurent R. Toxidermie àla névirapine:?étude des facteurs de risque chez 101 malades infectés par le VIH. Ann Dermatol Venereol. 2005;132:970-4.
5. Carr A, Swanson C, Penny R, Cooper DM. Clinical and laboratory markers of hypersensitivity to trimethoprim-sulfamethoxazole in patients with Pneumocystis carinii pneumonia and AIDS. J Infect Dis. 1993;167:180-5.
6. Carr A, Tindall B, Cooper DA. Patterns of multiple drug hypersensitivity in HIV-infected patients. AIDS. 1993;7:1532-3.
7. Milpied-Homsi B, Relliquet V, Huart A, Raffi F. Toxicitécutanée de la névirapine utilisée en première intention dans le traitement de 100 patients. Ann Dermatol Venereol. 1999;1126:2S21.
8. Fagot JP, Mockenhaupt M, Bouwes-Bavinck JN, Naldi L, Viboud C, Roujeau JC, et al. Nevirapine and the risk of Stevens-Johnson syndrome or toxic epidermal necrolysis. AIDS. 2001;15:1843-8.
9. CisséM, Soumah MM, Tounkara TM, DianéBF, Sako BF, BaldéH, et al. Lyell syndrome with fatal outcome in two pregnant women receiving antiretroviral therapy in Guinea, Conakry. JCDA. 2013;3:135-8.
10. Bastuji-Garin S, Rzany B, Stern RS, Shear NH, Naldi L, Roujeau JC. Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome and erythema multiforme. Arch Dermatol. 1993;129:92-6.
11. Auquier-Dunant A, Mockenhaupt M, Naldi L, Correia O, Schro- der W, Roujeau JC, et al. Severe cutaneous adverse reactions. Correlations between clinical patterns and causes of erythema multiforme majus, Stevens-Johnson syndrome, and toxic epidermal necrolysis:results of an international prospective study. Arch Dermatol. 2002;138:1019-24.
12. CisséM, Niang SO, Keïta M, Soumah MM, Camara A. Toxidermies au cours du traitement antirétroviral àConakry, Guinée. Med Trop. 2008;68:203.
13. Begaud B, Evreux JC, Jouglard J, Lagier G. Imputabilitédes effets inattendus ou toxiques des médicaments. Actualisation de la méthode utilisée en France. Therapie. 1985;40:111-8.
14. Kourouma S, SangaréA, Kaloga M, Kouassi I, Ecra E, Gbery I, et al. Syndromes de Stevens-Johnson et de Lyell:Étude de 185 cas au CHU de Treichville (Abidjan, Côte d’Ivoire). Méd SantéTropica. 2014;24:94-8.
15. Diop A, DiousséP, Almamy D, Ndiaye M, Diatta BA, Diallo M, et al. Toxidermies aux ARV chez les patients vivant avec le VIH (PVVIH) au sénégal:étude transversale de 6 ans. Rev Int Sc Méd. 2014;16,3:176-80.
16. Bersoff-Matcha SJ, Miller WC, Aberg JA, Van Der Horst C, Hamrick Jr HJ, Powderly WG, et al. Sex differences in nevirapine rash. Clin Infect Dis. 2001;32:124-9.
17. Antinori A, Baldini F, Girardi E, Cingolani A, Zaccarelli M, Di Giambenedetto S, et al. Female sex and the use anti-allergic agents increase the risk of developing cutaneous rash associated with nevirapine therapy. AIDS. 2001;15:1579-81.
18. Mazhude C, Jones S, Murad S, Taylor C, Easterbrook P. Female sex but not ethnicity is a strong predictor of non nucleoside reverse transcriptase inhibitor induced rash. AIDS. 2002;16:1566-8.
19. Launay O, Roudiere L, Boukli N, Dupont B, Prevoteau Du Clary F, Patey O, David F, et al. Assessment of cetirizine, an antihistamine, to prevent cutaneous reactions to nevirapine therapy;result of the viramune-zyrtec double-blind, placebo-controlled trial. Clin Infect Dis. 2004;38:66-72.
20. Knobel H, Miro JM, Mahillo B, Domingo P, Rivero A, Ribera E, et al. Failure of cetirizine to prevent nevirapine-associated rash:A double-blind placebo-controlled trial for the GESIDA 26/01 Study. J Acquir Immune Defic Syndr. 2004;37:1276-81.
21. Derisi M, Ballard C, Abulhosn K, Colwell B, Barber E, Mathews WC. Sulfonamides associated rash and race are risk factors for non nucleoside reverse transcriptase inhibitors associated rash (Abstract 61). 7th Conference for retrovirology and human health infections. San-Francisco, 2000.
22. Kohlbrenner V, Dansfield K, Cotton D, Robinson P, Myers M. Cutaneous eruptions associated with nevirapine therapy in HIV-1 infected patients individuals (abstract MoB 12021). 10th International Conference on AIDS, Vancouver, 1996.
23. Montaner JS, Cahn P, Zala C, Cassetti LI, Losso M, Hall DB, et al. Randomized, controlled study of the effects of short course of prednisone on the incidence of rash associated nevirapine in patients infected with HIV-1. J Acquir Immune Defic Syndr. 2003;33:41-6.
24. Konare HD, CisséIA, Oumar AA, Idrissa S, Maiga S, Dao S, Rhaly A, Tounkara A. Toxidermie médicamenteuse en milieu hospitalier àBamako. Mali Méd. 2012;27:57-61.
25. Barner A, Myers M. Nevirapine and rashes. Lancet. 1998;351:1133.
26. Caumes E, Bossi P, Katlama C, Bricaire F. Toxidermies dues aux antirétroviraux chez les patients infectés par VIH. Presse Med. 2003;32:1325-33.
27. Bonnet F, Lawson-Ayayi R, Thiebaut R, Ramanampamonjy R, Lacoste D, Bernard N, et al. A cohort of nevirapine tolerance in clinical practice:French Aquitaine cohort 1997-1999. Clin Infect Dis. 2002;35:1231-7.
28. Pollard RB, Robinson P, Dransfield K. Safety profile of nevirapine a nonnucleosid reverse transcriptase inhibitor for the treatment of HIV. Clin Ther. 1998;20:1071-92.
29. Rotunda A, Hirsch RJ, Scheinfeld N, Weinberg JM. Severe cutaneous reactions associated with the use of human immunodeficiency virus medications. Acta Derm Venereol. 2003;83:1-9.
30. Bourezane Y, Salard D, Hoen B, Vandel S, Drobacheff C, Laurent R. DRESS (Drug Rash with Eosinophilia and Systemic Symptoms) syndrome associated with nevirapine therapy. Clin Infect Dis. 1998;27:1321-2.
Notes
Request permissions
If you wish to reuse any or all of this article please use the e-mail (brzezoo77@yahoo.com) to contact with publisher.
| Related Articles | Search Authors in |
|
 http://orcid.org/0000-0003-2794-7870 http://orcid.org/0000-0003-2794-7870 http://orcid.org/0000-0003-1371-5198 http://orcid.org/0000-0003-1371-5198 |




Comments are closed.